Ley de los Gases
Una muestra de gas tiene cuatro propiedades básicas físicas: presión (P), volumen (V), temperature (T) y la cantidad en moles (n). Estas propiedades están interelacionadas cuando una propiedad cambia, afecta la otra o puede afectar más de una propiedad. La ley de los gases describe la relación entre dos o más propiedades manteniendo otras constantes. Por ejemplo, la Ley de Boyle indica como varía el volumen con la presión a temperatura y cantidad de moles constante. Otras leyes de gases lo son: Ley de Charles, Ley de Amonton, Ley de Gases Combinadas, Ley de Avogadro y Ley de Gases Ideales. Ley de Gases Ideales puede ser utilizado para determinar la densidad (d) y masa molar (MM) del compuesto gaseoso.
1.
Ley de Boyle
2.
Ley de Charles
3.
Ley de Amonton
4.
Ley de Gases Combinadas
5.
Ley de Avogadro
6.
Ley de Gases Ideales
Aplicaciones de gases ideales: densidad y masa molar
7.
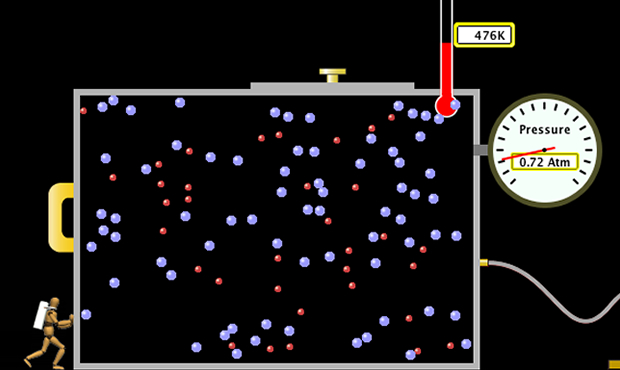
Laboratorio Interactivo: Propiedad del Gas
TutoriasOnline.com te brinda una nueva manera de estudiar y prácticar la ciencia, lo hacemos usando el sistema de PhET Interactive Simulation, de la Universidad de Colorado. Oprime la imagen abajo para poder ver interactivamente como funciona la Propiedad del Gas.